Tahukah anda, untuk menghantarkan listrik dibutuhkan sebuah larutan. Dilihat dari kemampuan menghantarkan arus listrik, terdapat dua jenis larutan, yaitu larutan elektrolit dan non elektrolit. Larutan elektrolit juga terdapat dalam tubuh manusia yang berfungsi untuk melancarkan impuls syaraf. Lalu larutan apa saja yang termasuk dalam larutan elektrolit dan larutan non elektrolit?
Untuk mengetahui lebih jelas tentang larutan elektrolit dan larutan non elektrolit. Berikut ini kami akan jelaskan secara lengkap tentang pengertian larutan elektrolit dan larutan non elektrolit, jenis larutan elektrolit dan larutan non elektrolit, manfaat larutan elektrolit dan larutan non elektrolit dan contoh larutan elektrolit dan larutan non elektrolit dengan penjelasan terlengkap.
Baca Juga : Larutan Penyangga dan Penjelasannya
Pengertian Elektrolit
Elektrolit adalah suatu zat yang dapat larut dan teruai menjadi ion-ion. Ion-ion tersebut merupakan atom-atom bermuatan elektrik, sehingga larutannya dapat menjadi kondukror elektrik yang mampu menghantarkan arus listrik.
Umumnya, elektrolit adalah asam, basa atau garam, namun bisa juga berupa air atau senyawa kimia lainnya.
Larutan elektrolit juga terdapat dalam tubuh manusia yang berfungsi untuk melancarkan impuls syaraf. Lalu, apa saja cairan elektrolit tersebut? Cairan elektrolit adalah mineral bermuatan listrik yang ada dalam tubuh manusia. Cairan elektrolit tersebut dapat ditemukan dalam darah, keringat, air seni, dan cairan tubuh lainnya.
Sedangkan zat-zat yang disebut elektrolit meliputi sodium, potasium, klorin, magnesium, kalsium, dan bikarbonat.
Larutan elektrolit dibagi menjadi dua jenis yaitu larutan elektrolit dan larutan non elektrolit.
Baca Juga : Fermentasi dan Penjelasannya
Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listri, memberikan gejala seperti menyalakan lampu pada alat uji atau timbulnya gelembung gas dalam larutan.
Berdasarkan kekuatan daya hantar listriknya, larutan elektrolit dibagi menjadi dua, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.
Larutan elektrolit kuat
Larutan elektrolit adalah larutan yang mengalami ionisasi sempurna sehingga memiliki nilai derajat ionisasi sama dengan 1. Larutan yang termasuk dalam larutan elektrolit kuat berupa asam kuat, basa kuat, dan garam yang terbentuk dari reaksi asam kuat dan basa kuat.
Larutan elektrolit kuat mengalami ionisasi sempurna, karena itulah jumlah ion dalam senyawa ini sangat banyak sehingga dapat menghantarkan arus listrik dengan baik yang ditandai dengan nyala lampu pada alat uji menjadi terang. Banyaknya jumlah ion dapat diketahui dari banyaknya jumlah gelembung gas yang terbentuk, semakin banyak ion, maka semakin banyak gelembung yang terbentuk.
Contoh larutan elektrolit kuat:
- Garam (NaCl, KCl, CuSO4 dan KNO3),
- Asam Kuat (HCl, HI, HBr, H2SO4 dan HNO3),
- Basa Kuat (NaOH, Ca(OH)2, Mg(OH)2 dan KOH).
Penulisan reaksi penguraian elektrolit ditulis dengan tanda anak panah tunggal ke kanan. Contoh reaksi elektrolit kuat yaitu:
- NaCl (aq) → Na+ (aq) + Cl– (aq)
- H2SO4 (aq) → 2 H+ (aq) + SO4 2- (aq)
- NaOH (aq) → Na+ (aq) + OH– (aq)
Baca Juga : Kimia Organik dan Penjelasannya
Larutan elektrolit lemah
Larutan elektrolit lemah adalah larutan yang menghantarkan arus listrik secara lemah. Larutan elektrolit lemah disebabkan karena ionisasi yang dialaminya tidak sempurna sehingga menghasilkan jumlah ion yang sedikit, yaitu jumlah nilai derajat ionisasi larutan lebih rendah dari 1 namun lebih tinggi dari 0.
Jika dilakukan pada alat uji, nyala lampu pada larutan elektrolit lemah cenderung redup bahkan tidak menyala jika nilai derajat ionisasinya sudah mendekati 0. Selain itu, gelembung gas yang terbentuk dari larutan ini juga cenderung lebih sedikit.
Contoh Larutan Elektrolit Lemah
- Asam Lemah (HCN, H3PO4, CH3COOH, dan C2O3)
- Basa Lemah (NH4OH, Al(OH3),dan Fe(OH)3).
Larutan Non Elektrolit
Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik karena larutan ini tidak menghasilkan ion-ion. Contohnya larutan urea (CO(NH2)2) dan larutan gula (C12H22O11).
Larutan non elektrolit terdiri dari zat-zat larut dalam air namun tidak terurai menjadi ion (tidak terionisasi). Dalam larutan, zat non elektrolit seperti molekul yang tidak bermuatan listrik. Karena itulah larutan non elektrolit tidak dapat menghantarkan arus listrik.
Contoh larutan non elektrolit:
- Urea = CO (NH2)2
- Glukosa = C6H12O6
- Sukrosa = C12H22O11
- Etanol = C2H2OH
Baca Juga : Hidrokarbon dan Penjelasannya
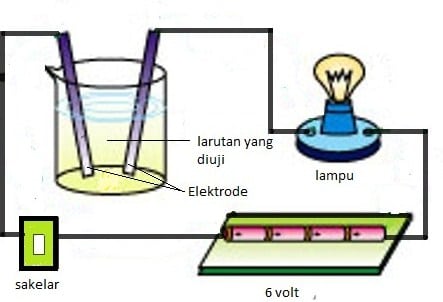
Cara Pengujian Larutan Elektrolit
Cara mengetahui apakah suatu larutan bersifat elektrolit atau tidak dapat diketahui dengan melakukan pengujian menggunakan alat uji elektrolit yang mengukur kemampuan suatu larutan dalam menghantarkan aur listrik. Alat uji elektrolit tersebut terdiri dari dua elektroda yang dirangkai dengan lampu pijar yang dihubungkan dengan tegangan listrik.
Dibawah ini adalah contoh alat uji elektrolit:
Sifat elektrolit suatu larutan dipengaruhi oleh banyaknya ion yang bergerak bebas. Berdasarkan percobaan dengan alat uji elektrolit, maka larutan elektrolit dan non elektrolit menunjukkan hasil yang berbeda, yaitu:
- Jika pada percobaan suatu larutan menyebabkan lampu menyala terang dan timbul gelembung gas di sekitar elektroda, maka larutan tersebut memiliki daya hantar listrik yang baik sehingga termasuk jenis larutan elektrolit kuat. Sedangkan jika lampu redup atau tidak menyala namun masih terdapat gelembung gas di sekitar elektroda, maka larutan tersebut memiliki daya hantar listrik jenis elektrolit lemah.
- Jika pada percobaan suatu larutan tidak menyebabkan lampu menyala dan disekitar elektroda tidak muncul gelembung gas, maka larutan tersebut tidak memiliki daya listrik yang disebut jenis larutan non elektrolit.
Berikut ini tabel contoh hasil eksperimen uji elektrolit pada beberapa larutan, antara lain:
[table id=28 /]
Dari tabel tersebut disimpulkan bahwa garam dapur merupakan larutan elektrolit kuat, amonium hidroksida merupakan larutan elektrolit lemah, dan larutan gula merupakan larutan non elektrolit.
Kekuatan larutan elektrolit dinyatakan dengan ionisasi atau derajat disosiasi yang dilambangkan dengan alfa “α”. Nilai alfa “α” adalah perbandingan anatar jumlah mol yang terionisasi dengan jumlah mol yang dilarutkan dalam satuan.
Rumus yang berlaku pada larutan yaitu
nilai α sekitar 0-1 dengan ketentuan berikut ini:
- Jika nilai α = 1, maka larutan terionisasi atau terdisosiasi sehingga sempurna yang merupakan elektrolit kuat.
- Jika 0 < α < 1, maka larutan terionisasi atau terdisosiasi sehingga merupakan elektrolit lemah
- Jika α = 0, maka larutan tidak terionisasi atau terdisosiasi sehingga merupakan larutan non elektrolit.
Nilai α menjelaskan kekuatan nyala lampu dan banyaknya gelembung gas pada elektroda saat uji elektrolit.
Baca Juga : Unsur Unsur Radioaktif dan Penjelasannya
Manfaat Larutan Elektrolit
Pada penjelasan diatas sempat disinggung jika larutan elektrolit juga ada dalam tubuh manusia yang berfungsi membantu melancarkan impuls-impuls syaraf tubuh. Selain itu, larutan elektrolit juga memiliki banyak manfaat lain bagi kehidupan manusia, berikut diantaranya:
- Larutan elektrolit diguanakan sebagai sel elektrokimia pada bagian mesin kendaraan, seperti pengisi aki, baterai dan jembatan garam.
- Dalam tubuh manusia, larutan elektrolit berperan untuk melancarkan impuls syaraf juga dalam mekanisme metabolisme tubuh yaitu sebagai pembentuk dan ion pengaktif enzim tubuh. Selain itu, larutan elektrolit juga berperan sebagai pengatur keasaman dan kadar cairan dalam tubuh.
Contoh Larutan Elektrolit dan Larutan Non Elektrolit
Contoh larutan elektrolit
- Larutan elektrolit kuat, contohnya:
- Asam kuat : HCI, HBr, HNO3, H2SO4, HCIO3, HCIO4
- Basa Kuat : NaOH, KOH, Mg(OH)2, Ca(OH)2, Ba(OH)2
- Garam juga termasuk elektrolit kuat, contohnya NaCI, BaCI2
- Larutan elektrolit lemah, contohnya:
- Asam lemah : CH3COOH (Asam cuka), H3PO4 (asam folat), dll
- Basa lemah : AI(OH)3, Fe(OH2), AgOH), dll
Contoh Larutan Non Elektrolit
Larutan selain asam, basa, dan garam, contoh: gula, alkohol, glukosa, urea, dll.
Baca Juga : Benzena dan turunannya serta Penjelasannya
Demikian artikel mengenai Larutan ELektrolit dan Non Elektrolit Serta Penjelasannya. Semoga artikel ini dapat bermanfaat dan menambah wawasan anda mengenai pelajaran Ilmu Pengetahuan Alam.