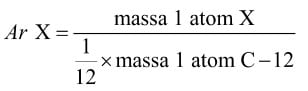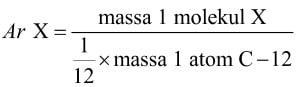Hukum dasar kimia merupakan dasar yang perlu dipelajari untuk mengetahui cara kerja dan konsep dalam lingkup kimia. Sebelum mengetahui hukum dasar kimia, terdapat beberapa hal yang perlu dipelajari seperti massa atom relatif dan massa molekul relatif yang akan dijelaskan dibawah ini.
Perlu diketahui bahwa lahirnya ilmu kimia tidak lepas dari ahli-ahli yang melakukan banyak penelitian terkait masalah kimia, seperti Avogadro, Proust, Lavoisier, dan yang lainnya. Ahli-ahli tersebut dikenal sebagai peletak hukum dasar kimia. Lalu, Apa itu hukum dasar kimia?
Dibawah ini akan dijelaskan secara keseluruhan tentang hukum dasar kimia. Namun sebelumnya akan dijelaskan terlebih dahulu tentang massa atom relatif (Ar) dan massa molekul relatif (Mr).
Baca Juga: Tata Nama Senyawa Hidrokarbon dan Penjelasannya
Massa Atom Relatif (Ar)
Massa atom relatif (Ar) adalah massa sutau atom yang didapatkan dari rasio perbandingan standarnya. Untuk memudahkan perhitungan, massa atom relatif dinyatakan sebagai perbandingan massa 1 atom dan 1/2 massa 1 atom C-12.
Secara matematis, massa atom relatif dirumuskan sebagai berikut:
Massa Molekul Relatif (Mr)
Massa molekul relatif (Mr) adalah massa molekul suatu senyawa berdasarkan berat karbon-12 sebagai acuannya, yaitu perbandingan antara massa 1 molekul unsur atau senyawa dan 1/2 massa 1 atom C-12.
Selain itu, massa molekul realtif juga menunjukkan massa total realtif unsur-unsur penyusun suatu molekul.
Massa molekul dihitung berdasarkan jumlah massa atom relatif semua atom penyusunnya. Persamaan yang digunakan yaitu:
Baca Juga : Hidrokarbon dan Penjelasannya
Hukum Dasar Kimia
Pengertian hukum dasar kimia adalah terori yang merumuskan fakta-fakta empiris dari berbagai observasi dan eksperimen kimia yang dilakukan berulang-ulang dengan menggunakan metode ilmiah.
Hukum dasar kimia perlu dipahami sebelum mempelajari aspek kuantitatik dan kualitatis ilmu kimia. Aspek kuantitatis meliputi keterkaitan jumlah zat-zat yang terlibat pada reaksi kimia, sedangkan aspek kualitatis meliputi penentuan zat.
Hukum dasar kimia terdiri dari beberapa bagian hukum yaitu hukum Lavoisier, hukum Proust, hukum Dalton, hukum Gay-Lussac, dan hukum Avogadro. Dibawah ini penjelasan hukum dasar kimia.
1. Hukum Lavoisier (Hukum Kekekalan Massa)
Hukum Lavoisier ditemukan oleh ilmuwan asal Prancis yaitu Antonie Laurent Lavoisier. Berdasarkan pengamatannya, Lavoisier menemukan bahwa “Massa total zat sebelum reaksi sama dengan massa total zat setelah reaksi”
Dengan kata lain, dalam reaksi kimia atom-atom tidak dimusnahkan, tidak diciptakan maupun diubah menjadi atom lain, hanya saja mengalami perubahan susunan menjadi partikel zat yang berbeda.
Berdasarkan eksperimen-eksperrimen yang dilakukannya, Lavoisier juga menemukan peranan gas oksigen dalam reaksi-reaksi pembakaran. Massa oksigen yang bereaksi dalam reaksi pembakaran juga diperhitungkan. Selain itu, gas yang terlibat dalam reaksi kimia sebagai pereaksi juga memiliki massa yang turut diperhitungkan dalam pengamatan kuantitatif setiap reaksi dalam eksperimen kimia.
Pada eksperimen reaksi pemanasan 572,4 g calx merkuri (HgO) menghasilkan 530 g logam merkuri (Hg) dan 42,4 g gas oksigen (O2), terlihat bahwa total massa zat sebelum reaksi (572,4 g) sama dengan total massa zat setelah reaksi (530 g + 42,4 g). Eksperimen tersebut sesuai dengan hukum kekelan massa, dimana reaksi kimia tidak terjadi perubahan massa.
Contoh Soal Hukum Lavoisier
Tentukan massa belerang yang bereaksi pada sebuah besi bermassa 21 gram yang direaksikan dengan belerang sehingga membentuk 33 gram besi belerang.
Jawab:
Persamaan yang berlaku yaitu
Massa besi + massa belerang → massa besi belerang
21 gram + ? → 33 gram
Berdasarkan hukum Lavoisier, massa zat sebelum dan setelah reaksi adalah sama, maka diperoleh persamaan sebagai berikut:
21 gram + massa belerang = 33 gram
⇔ massa belerang = 33 – 21
⇔ massa belerang = 12 gram
Jadi, massa belerang yang bereaksi adalah 12 gram.
Baca Juga : Larutan Penyangga dan Penjelasannya
2. Hukum Proust (Hukum Perbandingan Tetap)
Pada tahun 1799, seorang ilmuwan asal Prancis yaitu Joseph Louis Proust melakukan penelitian perbandingan massa unsur yang terkandung dalam suatu senyawa. Berdasarkan penelitian tersebut menghasilkan bahwa setiap senyawa tersusun atas unsur-unsur dengan komposisi tertentu dan tetap. Karena itulah, bunyi hukum proust adalah “Perbandingan massa unsur-unsur dalam suatu senyawa adalah tertentu dan tetap”.
Pada ekperimen reaksi unsur hidrogen (H2) dengan unsur oksigen (O2) membentuk senyawa air (H2O), diperoleh bahwa perbandingan massa hidrogen dengan massa oksigen yang bereaksi selalu tetap, yakni 1 : 8. Perhatikan tabel perbandingan dibawah ini:
[table id=32 /]
Contoh Soal Hukum Proust
Sebuah senyawa karbondioksida dibentuk dari unsur karbin dan oksigen dengan perbandingan massa karbon dan oksigen 3:8. Jika unsur karbon yang bereaksi 1,5gram, tentukan massa oksigen yang bereaksi dan massa karbon yang terbentuk.
Jawab:
Persamaan yang digunakan yaitu:
Massa karbon : Massa oksigen : Massa karbondioksida
3 : 8 : 11
1,5gram : ? : ?
Berdasarkan hukum perbandingan unsur dan massa yang diketahui, maka:
Massa oksige yang dibutuhkan adalah:
= 8/3 x 1,5 = 4 gram
Massa karbondioksida yang terbentuk adalah:
= 11/3 x 1,5 = 5,5 gram
Atau, Massa karbondioksida juga dapat ditentukan berdasarkan hukum Lavoisier, yaitu:
massa karbondioksia = massa karbon + massa oksigen
= 1,5 + 4 gram
= 5,5 gram
Jadi, massa oksigen yang bereaksi adalah 4 gram, dan massa karbondioksida yang terbentuk adalah 5,5 gram.
Baca Juga : Kimia Organik dan Penjelasannya
3. Hukum Dalton (Hukum Kelipatan Perbandingan)
Hukum Dalton dikemukakan oleh seorang ilmuwana asal Inggris yaitu John Dalton. John Dalton melakukan penelitian dengan membandingkan massa unsur-unsur pada beberapa senyawa, contohnya oksida karbon dan oksida nitrogen.
Senyawa yang digunakan oleh Dalton adalah Karbon Monoksidan (CO) dan karbon dioksida (CO2). Perbandingan dari kedua senyawa tersebut adalah:
[table id=31 /]
Dari tabel tersebut, jika massa karbon dalam CO dan CO2 sama, maka oksigen didalamnya akan memenuhi perbandingan tertentu. Perbandingan massa oksigen yang diperoleh Dalton pada senyawa CO dan CO2 adalah 4 : 8 = 1 : 2. Karena itulah hukum Dalton dikenal sebagai hukum kelipatan perbandingan.
Bunyi hukum Dalton yaitu “Jika dua unsur dapat membentuk lebih dari satu senyawa dengan salah satu massa unsur di buat tetap, maka perbandingan massa unsur lainnya dalam senyawa tersebut merupakan bilangan bulat yang sederhana”.
Contoh Soal Hukum Dalton
Terdapat sebuah senyawa oksida nitrogen (NxOy) yang tersusun berdasarkan unsur oksigen dan nitrogen dengan komposisi sebagai berikut:
Senyawa I memiliki Massa Nitrogen 28gr dan Massa oksigen 16.
Senyawa I memiliki Massa Nitrogen 28gr dan Massa oksigen 48.
Tentukan perbandingan antara massa oksigen pada senyawa I dan II?
Jawab:
Cara menentukan perbandingan pada kedua senyawa tersebut yaitu hanya dengan melihat massa oksigen yang diketahui. Hal ini karena massa nitrogennya sudah sama, maka rumus yang digunakan adalah sebagai berikut:
Massa oksigen I : Massa oksigen II
16 gr : 48 gr
1 : 3
Jadi perbandingan massa oksigen pada kedua senyawa tersebut adalah 1 : 3.
Baca Juga : Persamaan Reaksi Kimia dan Penjelasannya
4. Hukum Gay Lussac (Hukum Perbandingan Volume)
Hukum Gay Lussac merupakan hukum dasar kimia yang dikemukakan oleh ilmuwan asal Prancis yaitu Joseph Gay Lussac. Gay Lussac melakukan penelitian tentang volume gas dalam suatu reaksi kimia. Berdasarkan penelitian yang dilakukannya, Gay Lussac mengambil kesimpulan bahwa perubahan volume gas yang dipengaruhi oleh suhu dan tekanan. Pada suhu dan tekanan tertentu, 1 liter gas nitrogen bereaksi dengan 3 liter hidrogen menghasilkan 2 liter gas amonia.
Persamaan reaksi pada hukum Gay Lussac yaitu:
Bunyi hukum Gay Lussac yaitu “Pada suhu dan tekanan yang sama, perbandingan volume gas yang bereaksi dan hasil reaksi merupakan bilangan bulat yang sederhana”.
Contoh Soal Hukum Gay Lussac
Tentukan gas hidrogen klorida yang dihasilkan dari 1 liter gas hidrogen yang bereaksi dengan 1 liter gas klorin sehingga menghasilkan 2 liter gas hidrogen klorida. Jika gas hidrogen yang direaksikan adalah 5 liter.
Jawab:
Gunakan perbandingan berikut ini:
Volume H2 : volume CI2 : Volume HCI
1 : 1 : 2
5 : 5 : 10
Jadi gas hidrogen klorida yang dihasilkan adalah 10 liter.
5. Hukum Avogadro (Hipotesis Avogadro)
Hukum Avogadro merupakan hukum dasar kimia yang dikemukakan pada tahun 1811 oleh ilmuwan asal Italia yaitu Amadeo Avogadro. Amadeo Avogadro menyatakan bahwa partikel unsur tidak selalu berupa atom yang berdiri sendiri melainkan berbentuk molekul unsur, contohnya H2, O2, N2, dan P4.
Berdasarkan hal tersebut, Avogadro menjelaskan bahwa hukum Avogadro yaitu “Pada suhu dan tekanan yang sama, perbandingan volume gas yang volumenya sama memiliki jumlah molekul yang sama pula”.
Berdasarkan hipotesis tersebut didapatkan bahwa perbandingan volume gas sama dengan perbandingan koefisien. Persamaan pada hukum avogadro adalah sebagai berikut:
Demikian artikel mengenai Hukum Dasar Kimia dengan Penjelasannya. Semoga artikel ini dapat bermanfaat dan menambah wawasan anda mengenai pelajaran Ilmu Pengetahuan Alam.