Sel volta adalah sel elektrokimia yang dapat mengubah energi kimia menjadi energi listrik melalui reaksi redoks secara spontan. Dalam menghasilkan arus listrik, sel volta memiliki prinsip kerja, aliran transfer elektron dari reaksi oksidasi di anode ke reaksi reduksi di katode melalui rangkaian luar. Sel volta disebut juga dengan sel galvani.
Untuk mengetahui lebih jelas tentang sel volta, berikut ini akan dijelaskan secara lengkap tentang pengertian sel volta, prinsip kerja sel volta, bagian-bagian sel volta, dengan pembahasan terlengkap.
Baca Juga : Benzena dan turunannya serta Penjelasannya
Pengertian Sel Volta
Sel volta adalah sel elektrokimia yang dapat mengubah energi kimia menjadi energi listrik melalui reaksi redoks secara spontan.
Sel volta atau sel galvani merupakan gagasan yang lahir dari seorang ilmuwan berkebangsaan Italia yaitu Alessandro Giuseppe Volta ( 1745-1827) dan Lugini Galvani (1737-1798).
Disebut sel galvani karena kata Galvani berasal dari Lugini Galvani yang menemukan fenomena adanya sifat listrik pada tulang. Sedangkan disebut sel volta karena kata Volta berasal dari Alessandro Giuseppe Volta yang melakukan percobaan dan menyatakan bahwa kontak dua logam yang berbeda dapat menimbulkan listrik.
Pernyataan dari Alessandro Giuseppe Volta membantah pernyataan dari Luigi Galvani yang sekaligus menjelaskan lebih lanjut mengenai fenomena tersebut.
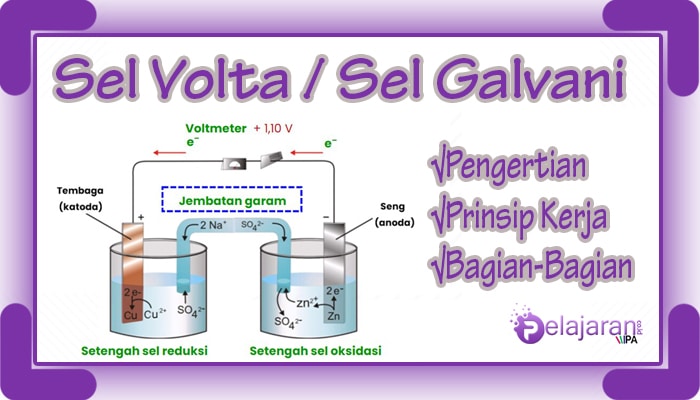
Sel volta terdiri dari 4 bagian, yaitu Voltmeter, Jembatan Garam, Anoda, dan Katoda.
- Voltmeter
Voltmeter berfungsi untuk menentukan besarnya potensial pistrik atau tegangan listrik yang dihasilkan. - Jembatan garam (salt bridge)
Jembatan garam (salt bridge) berfungsi menjaga kenetralan muatan listrik pada larutan. Jembatan garam terdiri dari senyawaNa2SO4. - Anoda (Elektroda Negatif)
Anoda merupakan tempat terjadinya reaksi oksidasi (pelepasan elektron). Pada gambar dibawah anoda yang digunakan adalah Zn (seng). - Katoda (Elektroda Positif)
Katoda merupakan tempat terjadinya reaksi reduksi (penangkapan elektron). Pada gambar dibawah katoda yang digunakan adalah Cu (tembaga).
Berdasarkan gambar tersebut, reaksi kimia yang terjadi pada sel volta adalah:
(Anoda) Zn → Zn2+ + 2e¯
(Katoda) Cu2+ + 2e¯ → Cu
Pada sel volta terjadi perubahan energi kimia menjadi energi listrik yang disebut dengan reaksi spontan atau reaksi redoks (Reduksi-Oksidasi).
Syarat terjadinya reaksi spontan yaitu Nilai Potensial Elektroda Standar (E°) pada Voltmeter harus bernilai positif. Namun, jila nilai Potensial Elektroda Standar (E°)pada Voltmeter bernilai negatif maka tidak terjadi reaksi spontan.
Baca Juga : Larutan Penyangga dan Penjelasannya
Prinsip Kerja Sel Volta
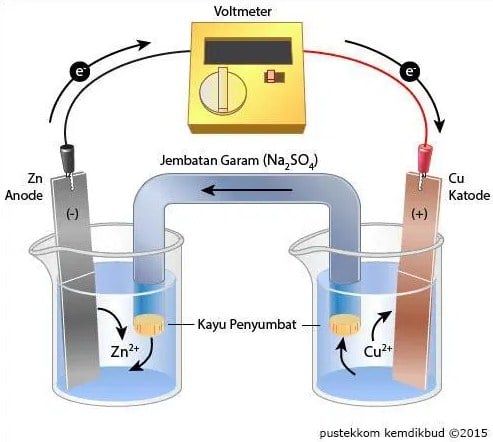
Prinsip kerja sel volta yaitu, jika logam Zn dimasukkan dalam larutan yang mengandung ion Zn2+ dan logam Cu dimasukkan ke dalam larutan Cu2+, maka atom-atom logam Zn akan teroksidasi melepaskan 2 elektron dan larut dalam larutan tersebut hal ini karena larutan tersebut lebih reaktif dibandingkan dengan atom Cu.
Elektron-elektron yang dibebaskan oleh logam Zn akan melewati kawat dan masuk ke arah logam Cu dan tereduksi ion Cu2+ sehingga jumlah Cu2+ akan berkurang dalam larutan.
Elektroda atau kawat akan mengalirkan arus listrik (elektron) masuk dan keluar dari suatu larutan sehingga muncul tegangan listrik yang dapat dilihat dari Volmeter.
Secara umum, Reaksi spontan pada sel Volta adalah sebagai berikut:
Zn + Cu2+ → Zn2+ + Cu
Baca Juga : Fermentasi dan Penjelasannya
Bagian-bagian Sel Volta
Sel volta dibagi menjadi tiga bagian, yaitu sel volta primer, sel volta sekunder, dan sel bahan bakar. Berikut penjelasannya.
1. Sel Volta Primer
Sel volta primer adalah komponen baterai atau disebut juga dengan sel Lenchance. Sel volta primer memiliki baterai dengan daya yang langsung habis jika selesai dipakai dan kompone baterai tidak dapat diisi ulang. Baterai tersebut dibagi menjadi beberapa jenis, yaitu sel kering seng-sarbon, baterai merkuri dan baterai perak oksida.
- Sel Kering Sel-Karbon
Sel kering seng-sarbon terdiri dari silinder zink yang berisi pasta campuran batu kawi (MnO2), Salmiak (NH4Cl), karbon (C), dan sedikit air. Bagian anoda baterai ini adalah logam seng (Zn), sedangkan bagian katodanya adalah grafit yang dicelupkan di tengah-tengah pasta. Baterai sel kering seng-sarbon biasanya dipakai pada alat elektronika seperti senter, radio, lampu, jam, dan lainnya.
Persamaan redoks dari baterai sel kering seng-sarbon adalah sebagai berikut:
Zn(s) → Zn2+ (aq) + 2e¯ (anoda)
2Mn02(s) + 2NH4+ (aq)2e¯ → Mn203(s) + H20(I) (katoda)
- Baterai Perak Oksida
Baterap perak oksida memiliki komponen yang sangat tipis. Anoda baterai perak oksida adalah seng (Zn), katoda nya adalah perak oksida (Ag20). Baterai perak oksida memiliki ketegangan 1,5V. Baterai perak oksida biasanya digunakan pada beberapa komponen alat seperti pada kamera, jam, dan kalkulator elektronik.
Reaksi yang terjadi pada baterai perak oksida adalah sebagai berikut:
Zn(s) + 20H¯(aq) → Zn(0H)2(s) + 2e¯ (anoda)
Ag20(s) + H20 + 2e¯ → 2Ag(s) + 20¯H (aq) (katoda)
Baca Juga : Kimia Organik dan Penjelasannya
2. Sel Volta Sekunder
Sel volta sekunder adalah komponen sel volta yang daya nya dapat di isi ulang. Contohnya Aki timbal, baterai lithium dan sel perang seng. Berikut penjelasannya:
- Aki timbal
Aki timbal merupakan baterai yang digunakan pada kendaraan bermotor. Komponen aki terdiri dari PbO2 sebagai katoda dan Pb (timah hitam) sebagai anoda. Kedua komponen tersebut dicelupkan pada larutan asam sulfat (H2SO4), dan reaksi yang terjadi adalah sebagai berikut:
Pb(s) + SO42¯(aq) → PbSO4(s) + 2e¯ (anoda)
PbO2(s) + 4H+(aq) + SO42¯(aq) + 2e¯ → PbSO4(s) + 2H2O (katoda)
Pengisian daya pada aki dilakukan dengan menghubungkan elektroda timbal ke kutub negatif sumber arus sehingga Pb2SO4 yang terdapat pada elektrolda timbal di reduksi. Berikut ini reaksi yang terjadi pada aki:
PbSO4(s) + H+(aq)+2e¯ → Pb(s) + HSO4¯(aq) (elektrode Pb sebagai katoda)
PbSO4(s) + 2H2O(I) → PbO2(s) + HSO4¯(aq) + 3H+(aq) + 2e¯ (elektrode Pb02 sebagai anoda)
- Baterai Litium
Baterai litium merupakan sumber bahan energi untuk mobil listrik. Mobil listrik merupakan mobil dengan sumber tenaga tidak menggunakan bensin namun menggunakan baterai litium yang dapat diisi ulang, karena itulah mobil listrik lebih ramah lingkungan dan lebih irit. Baterai litium memiliki komponen anoda yaitu litium dan katoda adalah MnO2. Baterai litium menghasilkan arus listrik yang lebih besar dan memiliki daya tahan lebih lama. Reaksi yang terjadi pada baterai litium adalah sebagai berikut:
Li | Li+ (pelarut non-air) | K0H (pasta) | MnO2, Mn(OH)3,C
- Sel Perak Seng
Pada sel perak seng memiliki komponen anodanya adalah seng (Zn) dan katodanya adalah perak (Ag). Anoda dan katoda pada komponen ini dihubungkan dengan larutan KOH. Komponen tersebut lebih ringan dibandingkan aki timbal dan memiliki daya yang lebih besar sehingga baterai ini digunakan pada kendaraan di arena balap seperti mobil Formula 1 agar memiliki kecepatan yang lebih besar.
Baca Juga : Hidrokarbon dan Penjelasannya
3. Sel Bahan Bakar
Sel bahan bakar menggunakan campuran bahan bakar sebagai sumber energinya. Sel bahan bakar memiliki sumber bahan bakar seperti campuran Hidrogen (H2) dengan Oksigen (O2) atau campuran gas alam dengan oksigen. Komponen katoda dari sel bahan bakar adalah gas oksigen dan anodanya adalah gas hidrogen. Sel bahan bakar biasanya digunakan pada pesawat untuk menjelajah luar angkasa seperti pesawat ulang-alik, pesawat challenger, dan pesawat columbia. Reaksi kimia pada sel bahan bakar adalah sebagai berikut:
Katoda : menghasilkan ion OH¯
O2(g) + 2H2O(I) + 4e¯→ 4OH¯ (aq)
Anoda : dari katode berreaksi dengan gas H2
H2(g) + 2OH¯(aq) → 2H2O(I) + 2e¯
Reaksi sel yang terjadi adalah:
O2(g) + 2H2(g) → 2H2O(I)
Baca Juga : Larutan ELektrolit dan Non Elektrolit Serta Penjelasannya
Demikian artikel mengenai Sel Volta dan Penjelasannya. Semoga artikel ini dapat bermanfaat dan menambah wawasan anda mengenai pelajaran Ilmu Pengetahuan Alam.